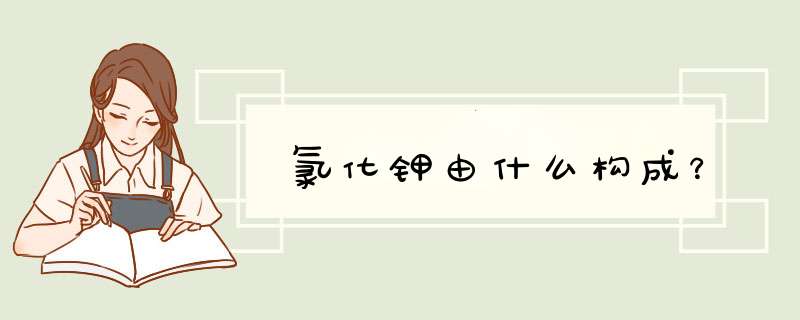
氯化钾由氯元素(Cl)和 钾元素(K)组成。
氯化钾是一种无机化合物,化学式为KCl,外观如同食盐,无臭、味咸。常用于低钠盐、矿物质水的添加剂。氯化钾是临床常用的电解质平衡调节药,临床疗效确切,广泛运用于临床各科。
用途:
主要用于无机工业,是制造各种钾盐或碱如氢氧化钾、硫酸钾、硝酸钾、氯酸钾、红矾钾等的基本原料。医药工业用作利尿剂及防治缺钾症的药物。染料工业用于生产G盐,活性染料等。农业上则是一种钾肥。其肥效快,直接施用于农田,能使土壤下层水分上升,有抗旱的作用.但在盐碱地及对烟草、甘薯、甜菜等作物不宜施用。氯化钾口感上与氯化钠相近(苦涩),也用作低钠盐或矿物质水的添加剂。此外,还用于制造枪口或炮口的消焰剂,钢铁热处理剂,以及用于照相。它还可用于医药,科学应用,食品加工,食盐里面也可以以部分氯化钾取代氯化钠,以降低高血压的可能性。
Cl(主要是Cl2)
(1) Cl2物理性质
通常情况下,氯气呈黄绿色,、有刺激性气味、比空气重的有毒气体,易液化,能溶于水。
(2) Cl2的化学性质
氯气的化学性质很活泼,是强氧化剂。
①跟金属反应
点 燃
2Na+Cl2 = 2NaCl(产生白烟)
点 燃
Cu+Cl2 =CuCl2(产生棕**的烟,溶于水溶液呈蓝绿色)
点 燃
2Fe+3 Cl2=2FeCl3(产生棕色的烟,溶于水溶液呈**)
注:常温下干燥的氯气或液氯不能与铁发生反应,所以工业上常把干燥的液氯储存在钢瓶中。
②跟非金属反应
点燃或光照
H2+Cl2 = 2HCl
点燃:发出苍白色火焰,有白雾(工业制盐酸)
光照:会发生爆炸(故不能用于工业制盐酸
③跟水反应
Cl2+H2O H++Cl-+HClO
(HClO不稳定,见光易分解)
光照
2HClO=2HCl+O2
氯水的成分:H2O、Cl2、HClO 、H+、Cl-、ClO-、OH-
氯水保存:密封储存于棕色试剂瓶里。
氯水可以用来杀菌消毒。
液氯、新制氯水、久置氯水比较
液氯 新制氯水 久置氯水
颜色、状态 黄绿色 液体
淡黄绿色 液体
变成无色液体
存在
的微粒 Cl2分子
H2O、Cl2、HClO 、H+、Cl-、ClO-、OH- H2O、、H+、Cl-、OH-
物质的类别 纯净物 混合物
混合物
遇干燥的蓝色石蕊试纸 无明显变化
先变红后褪色
变红
④跟碱反应
Cl2+2NaOH=NaCl+NaClO+H2O
离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
常用于 除去多余的氯气
2Cl2+2Ca(OH)2= CaCl2+Ca(ClO)2 +2H2O
离子方程式:2Cl2+4OH-=2Cl- +2ClO- +2H2O
工业上用氯气 和 石灰乳 制得漂白粉。
漂白粉的主要成分:CaCl2 和Ca(ClO)2;有效成分是Ca(ClO)2
漂白粉的漂白原理是:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
或Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
光照
由于上述反应生成2HClO=2HCl+O2↑,
故漂白粉露置在空气中,久置无效。
2 氯气的实验室制法
△
①原理:MnO2+ 4HCl(浓)=MnCl2+Cl2↑+2H2O
△
离子方程式:MnO2+ 4H+ + 2Cl-=Mn2+ + Cl2↑+2H2O
注意:稀盐酸与MnO2作用不能制取Cl2。
△
②制气类型:“固+液→气”型
③发生装置:分液漏斗、圆底烧瓶、铁架台、酒精灯、石棉网、导气管等
④收集方法:向上排空气法或排饱和食盐水的方法
⑤除杂:用饱和食盐水除去HCl,再用浓硫酸干燥(吸收水)
⑥尾气处理:用强碱溶液吸收多余的Cl2,防止污染环境。
3 卤素元素
(1) 元素在周期表中的位置:第ⅦA族
(2) 相同点:最外层电子数均为
原子结构 不同点:电子层数不同、原子半径不同
(3) 主要性质的递变性(从氟到碘):①原子半径和离子半径逐渐增大
②非金属性和单质的氧化性逐渐减弱③与氢气化合或与水反应由易到难
④氢化物的稳定性减弱⑤最高价氧化物的水化物酸性减弱⑥卤离子还原性增强⑦前面元素的单质能把后面元素置换出来⑧单质颜色逐渐加深,熔沸点升高,密度(溴反常外)依次增大。
(4) 卤素单质的特性
① F是最活泼的非金属元素,氧化性最强,无正化合价,无含氧酸;氢氟酸能腐蚀玻璃;AgF溶于水;氟遇到水发生剧烈反应,生成氟化氢和氧气:
2F2+2H2O=4HF+O2
② 朽是深红色液体,很容易挥发,应密封保存,并加少量水,作“水封”,以减少挥发
③ 溴、碘在水中的溶解度较小,但却比较容易溶解在汽油、苯、四氯化碳、酒精等有机溶剂中
④ 碘易升华;碘单质遇到淀粉出现蓝色;AgI可以用于人工降雨
(5) 萃取常用的主要仪器:分液漏斗
(6) 卤离子的检验:Cl-、Br-、I-。
用酸化AgNO3溶液生成沉淀颜色来判断:
Cl-+ Ag+=AgCl↓(白)
Br-+ Ag+=AgBr↓(浅黄)
I-+ Ag+=AgI↓(黄)
(7)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。 注意:写化学方程式时要可逆符号
(8)物质的量应用于化学方程式的计算
步骤:
① 根据题意写出化学方程式并配平
② 求出已知物和未知物的摩尔质量(有时也把化学计量数当坐物质量来写)
③ 把以知量和未知量分别写在化学方程式的下面
④ 将有关的四个量,列出比例式,求出要求的量
⑤ 简明的写出答案
注意:①正确书写化学方程式
②不纯的物质的数值要转化成纯净物的数值
③列出物理量时要“上下单位统一”
S(主要是SO2)
二氧化硫
(1) 物理性质
通常情况下,二氧化硫为无色、有刺激性气味的气体(熔点-76℃ );
易液化(沸点-10℃ );比空气重、有毒;
易溶于水(常温常压1体积水能溶解40体积二氧化硫)。
(2)化学性质
①具有酸性氧化物的通性
a、和水反应
SO2+ H2O H2 SO3(水溶液呈酸性)
亚硫酸(二元弱酸)
b 、和碱、弱酸盐反应( Ca(OH)2 、NaOH 、 NaHCO3等)
SO2+2NaOH===Na2 SO3+ H2O
c、和碱性氧化物反应 (Na2O CaO等)
SO2 +Na2O =Na2 SO3 CaO+ SO2=CaSO3
“固硫”原理: Ca0+S02=CaS03 2CaS03+02=2CaS04
类比CO2
②和氧气反应(显还原性)
催化剂
2SO2+O2 2 SO3
△
常温下,SO3是一种无色的固体,熔沸点都较低,与水反应生成硫酸,同时放出大量的热,
SO3 + H2O= H2SO4
③和还原剂反应(显氧化性)
SO2+2H2S==3S↓+2H2O
④二氧化硫的漂白性
检验二氧化硫气体的方法
通入SO2 加热
品红溶液 变为无色 变为红色
漂白性物质小结
物质 HClO、O3、氯水、Na2O2、H2O2 SO2 活性炭
作用原理 氧化作用
化合作用
吸附作用
变化 化学变化
化学变化
物理变化
稳定性 不可逆
可逆
问题:将等物质的量的Cl2与SO2分别通入品红溶液和紫色石蕊试液,会有什么现象
Cl2 + SO2 + H2O == 2HCl + H2SO4 (没有了漂白性)
(3)二氧化硫的污染(酸雨 pH<56)
①形成酸雨的成分:硫的氧化物(S02)、氮的氧化物(N02).
②来源
a 化石燃料(煤、石油)的燃烧
b 含硫矿石的冶炼
c 硫酸、硝酸、磷酸生产的废气
④ 酸雨的形成
SO2+H2O=H2SO3, 2H2SO3+02=2 H2SO4,
4NO2+O2+2H2O=4HNO3
(所以酸雨里有H2SO3、H2SO4、HNO3)
7 硫酸
(1)物理性质
纯硫酸是一种无色油状粘稠的液体,983%的浓硫酸是一种高沸点、难挥发的强酸,能与水以任意比混溶,溶解时放出大量的热。在纯硫酸中可以认为全部是以分子状态而存在的,
无 H+ 、 SO42- 等离子。
注意:稀释浓硫酸的方法
将浓硫酸沿器壁缓慢注入水中,并不断搅拌,使产生的热量迅速地扩散。
规律:两种液体混合时,要把密度大的加到密度小的液体中,如浓硫酸、浓硝酸混酸的配制方法是把浓硫酸沿器壁缓慢注入浓硝酸。
(2) 化学性质
①具有酸的通性:H2SO4=2H++ SO42-
②.浓硫酸的特性:
A吸水性(吸收水分子的性质,可用作干燥剂):
能用浓硫酸干燥的气体有:H2,O2,Cl2,CO2,CH4等。
不能用浓硫酸干燥的气体有:碱性气体,如NH3;
还原性气体,如H2S,HBr,HI等
B.脱水性(能将有机物中的氢、氧元素按水的组成脱去的性质)
区别吸水性和脱水性
吸水性吸的是水,原本就有现成的水;而脱水性脱的是氢氧两元素按水的组成形成的水,原本没有水
C.强氧化性:
a、与金属反应
△
Cu+2 H2SO4(浓)= CuSO4+SO2↑+2H2O
b.与非金属反应
△
C+2 H2SO4(浓)= CO2↑+2SO2↑+2H2O
注意:碳和浓硫酸反应生成产物所用的试剂和检验顺序及现象
先用无水CuSO4检验水,CuSO4由无色变为蓝色,接着用酸性KMnO4溶液或溴水检验SO2,溶液褪色,在把气体通入品红溶液中,品红溶液不褪色或颜色变浅,最后把气体通入澄清石灰水中,澄清石灰水变浑浊。
在常温下,冷的浓硫酸遇铁、铝因发生“钝化”,所以可以用铁或铝的容器储存冷的浓硫酸。
注意: 发生“钝化”并不等于不发生反应。
(3) 硫酸的用途
硫酸的性质
用途
难挥发性酸 制取易挥发性酸
强电解质 蓄电池
酸性 酸洗锈层、制化肥
吸水性
干燥剂
强氧化性
制炸药
(4)硫酸根离子的检验
正确操作为:
被检液先加足量的盐酸酸化(无现象),再滴加BaCl2溶液,若有白色沉淀生成,则含有硫酸根离子,反之,则无。
注意此处不用硝酸酸化也不能用盐酸酸化的Ba(NO3)2 溶液,以防止SO 被氧化成SO 而造成干扰。
原理:Ba2+ + SO42- = BaSO4↓
(2)SO32-的检验
步骤:加入盐酸,将产生的气体通入品红溶液中,红色褪去;或加入BaCl2溶液生成白色沉淀,加入稀盐酸,沉淀溶解并产生具有刺激性气味的气体。
原理:Ba2+ + SO32- = BaSO3↓
BaSO3 + 2H+ = Ba2+ + SO2↑+ H2O
Na
钠
(1) 钠的物理性质
钠是银白色的金属,有良好的导电性和传热性,密度比水的密度小,熔沸点低,硬度很低(能用小刀切开。
(2) 钠的化学性质
①与非金属的反应
常温下: 4Na+O2====2Na2O(白色)
加热:4Na+O2 2Na2O2(淡**)
2Na + S ==== Na2S
②钠跟水的反应
2Na + 2H2O ====2NaOH + H2↑
离子方程式:2Na + 2H2O ====2Na+ + OH- + H2↑
现象:概括为“浮、熔、游、响、红”五个字来记忆”
浮:密度比水轻
熔:反应放热,钠熔点低
游:反应产生气体(H2)
响:反应剧烈
红:生成NaOH,酚酞遇碱变红
补充:钠和盐的水溶液反应,钠先和溶液中的溶剂水反应,生成的氢氧化钠再和盐发生复分解反应。如钠和硫酸铜溶液反应时,钠先和水反应,生成的产物再和硫酸铜反应:
2Na + 2H2O ====2NaOH + H2↑
2NaOH + CuSO4 ====Cu(OH)2 ↓+ Na2SO4↑
综合: 2Na + CuSO4 + 2H2O ==== Cu(OH)2↓+ Na2SO4 + H2↑
(3) 钠的保存:保存在煤油里, 而锂保存在石蜡中
(4) 钠的存在:在自然界中以化合态存在,主要以氯化钠的形式存在
(5) 钠的用途:①制取Na2O2等化合物
②钾和钠的合金作原子反应对的导热剂
③作还原剂
④ 利用钠受热发出黄光,制成高压钠灯用在电光源上,其黄光射程远透雾能力强。
2钠的化合物
(1)比较钠的两种氧化物
Na2O Na2O2
电子式
Na+[ ]2-Na+
Na+[ ]2-Na+
化学键种类
离子键 离子键、非极性键
:
2:1 1:1
:
2:1 2:1
类 别 碱性氧化物 过氧化物(不属碱性氧化物)
颜 色
状 态 白色
固体 淡**
固体
生成条件 4Na+O2 2Na2O
(空气) 2Na+O2 Na2O2
(空气或氧气)
与H2O反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2
与HCl反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+O2↑+2H2O
与CO2反应 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2
Na2O2的用途:①漂白织物、麦秆、羽毛(利用其强的氧化性)
②用在呼吸面具中和潜水艇里作为氧气的来源
(2)比较碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
晶体
成分 Na2CO3•10H2O
(易风化) NaHCO3
溶解性 易溶于水
溶于水
与H+反应
剧烈程度 CO32-+2H+=CO2↑+H2O < HCO3-+H+=CO2↑+H2O
与OH-反应
HCO3-+OH-=CO32-+H2O
热稳定性
很稳定
不稳定
2NaHCO3 Na¬2CO3+H2O+CO2↑
Na2CO3用途:玻璃、制皂、造纸、纺织等工业中;
还可以用来制造其他钠的化合物。
NaHCO3用途:(1)制发酵粉;(2)治疗胃酸过多症的一种药剂
3碱金属
(1)在周期表中的位置:第ⅠA族
相同点:最外层电子数相同,都是1
(2)原子结构
不同点:电子层数不同
(3)递变性(按同一主族从上到下的顺序)
①原子半径由小到大②元素的金属性增强③对应的碱碱性增强④单质的熔沸点降低(除钾反常外)
(4)焰色反应:某些金属或它们的化合物在灼烧时使火焰呈特殊颜色的现象。
注意:①焰色反应并不是化学反应而是一种物理现象。
②颜色:钠:** 钾:浅紫色(透过蓝色钴玻璃观察)
③每次实验操作之后,都要用稀盐酸洗净金属丝,且使用金属丝时必须在火焰上灼烧至无色。以免对实验现象产生干扰。
④金属丝最好用铂丝,也可以用铁丝或镍、铬、钨丝代替
氯气
一、组成结构
1.原子结构:氯原子最外层有7个电子,反应中易得到1个电子.
2.分子结构:氯气分子为双原子分子,分子式Cl2.
3.离子结构:氯离子最外层有8个电子,因而很稳定.
84消毒液的主要成份是次氯酸钠。在使用过程中,次氯酸钠很容易水解出钠离子和次氯酸根离子,所以具有去污、褪色、杀菌的作用。其中,次氯酸根有个特性,就是能够穿透细胞膜,进入细胞内部,破坏细胞内部结构,导致细胞死亡,故也具有广谱性的消毒应用,如家庭、医院、公共场所等。从上述分析中不难看出,因为人体器官也是由细胞构成的,所以,84消毒液也会对人体器官(尤其是直接接触的皮肤,以及呼吸道)造成伤害。因此,在使用84消毒液等含氯清洁剂时,应该戴胶手套和口罩。
次氯酸的成分是氯和硫酸根。
次氯酸是一种氯元素的含氧酸,化学式为HClO,结构式H-O-Cl,其中氯元素的化合价为+1价。
它仅存在于溶液中,其浓溶液呈**,稀溶液无色,有非常刺鼻的、类似氯气的气味,而且极不稳定,是一种很弱的酸,比碳酸弱,和氢硫酸相当。次氯酸也有极强的漂白作用,它的盐类可用做漂白剂和消毒剂。
次氯酸主要作为消毒剂使用,被广泛用于物体表面、织物等污染物品以及水、果蔬和食饮具等的消毒。除上述用途外,次氯酸还可用于室内空气、二次供水设备设施表面、手、皮肤和黏膜的消毒。
次氯酸的基本用途:
次氯酸一般用作漂白剂、氧化剂和消毒剂。含有次氯酸根的盐被称为次氯酸盐。最广为人知的一种家用次氯酸盐消毒剂是次氯酸钠(NaClO)。
次氯酸具有强氧化作用和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的混合物)的有效成分。
漂白粉可由氯气和消石灰反应而制得:3Ca(OH)₂+2Cl₂=Ca(ClO)₂+CaCl₂·xCa(OH)₂·yH₂O+H₂O,在放置漂白粉的地方具有氯气的气味,是因为有一氧化二氯放出的缘故。
在生物学系统中,次氯酸可被视为白细胞例如中性粒细胞和单核细胞产生的毒性最强、丰度最高的氧化剂。次氯酸作为一种极强的氧化剂,可迅速攻击多种生理学相关的分子,包括硫醇、硫醚、胺类、氨基酸、核苷酸、抗坏血酸和多烯酸。
同时,次氯酸可生成反应性非常高的其他氧化剂,例如与H2O2和超氧阴离子反应可分别生成单线态氧和羟基自由基。
次氯酸作为消毒剂,被广泛用于物体表面、织物等污染物品以及水、果蔬和食饮具等的消毒。除上述用途外,次氯酸还可用于室内空气、二次供水设备设施表面、手、皮肤和黏膜的消毒。
Cl2+H2OH+ + Cl- +HClO
新制氯水:3种分子:Cl2(氯分子)、HClO(次氯酸分子)、H2O(水分子);4种离子:Cl-(氯离子)、H+(氢离子)、ClO-(次氯酸根离子) OH-(氢氧根离子)
久置氯水就是稀盐酸:H2O(水分子)、Cl-(氯离子)、H+(氢离子)、OH-(氢氧根离子)
欢迎分享,转载请注明来源:品搜搜测评网

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
